La fabrication des médicaments
La synthèse chimique.
2.1. Comment fabrique-t-on les médicaments ?
La fabrication de molécule, comme celles des médicaments, s’appelle une synthèse chimique.
Lors d’une transformation chimique, des réactifs réagissent entre eux pour former des produits.
La fabrication d’une molécule, pour un médicament suit les étapes suivantes :
- La synthèse, fabrication de la molécule.
- la séparation ou extraction : filtration, extraction par solvant, distillation …
- L’identification ou caractérisation : sur le banc kofler ou par chromatographie …
Il peut y en avoir d’autres étapes, comme la recristallisation.
Au laboratoire, on a souvent recourt à un montage de chauffage à reflux pour réaliser une synthèse chimique.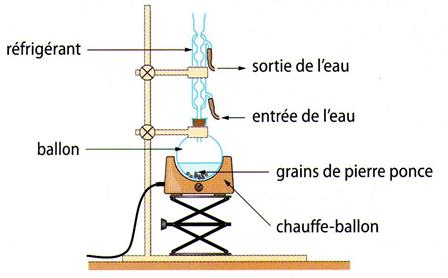
1.2. Modélisation d’une transformation chimique : l’équation de la réaction.
Lors d’une transformation chimique, un système chimique est le siège d’une ou plusieurs réactions chimiques. Une réaction chimique est modélisée par l’équation de la réaction. Exemple
On fait réagir du carbone C avec du dioxygène O2
Il se forme du dioxyde de carbone CO2
Équation de la réaction associée à cette transformation chimique
C + O2 → CO2
Dans l’équation de la réaction, les réactifs à gauches (ici C et O2) sont consommés et les produits à droite (ici CO2) se forment.
Lors d’une transformation chimique, les éléments chimiques se conservent.
On traduit cette propriété en équilibrant l’équation de la réaction pour avoir le même nombre de chaque élément de chaque côté de l’équation.
Les nombres permettant d’équilibrer l’équation s’appelle les nombres ou coefficients stœchiométriques.
Exemple : CH4 + 2O2 → CO2 + 2H2O
Dans cette équation, les nombres stœchiométriques sont : 1 - 2 - 1 - 2
2. Les solutions.
2.1. Qu’est-ce qu’une solution ?
Une solution est un mélange homogène formé par la dissolution d’une espèce chimique, appelée le soluté dans un liquide, le solvant.
Le solvant est l’espèce majoritaire, le soluté est l’espèce dissoute, minoritaire.
2.2. Les différents types de solutions
Une solution moléculaire, constituée de molécules, ne conduit pas le courant électrique.
Exemple : C12H22O11(s) → C12H22O11(aq)
Une solution ionique contenant des ions est conductrice du courant électrique. Exemple : NaCl(s) → Na+(aq) + Cl-(aq)
Un solide ionique ou une solution ioniques sont toujours électriquement neutre.
Par exemple : CaCl2 contient 1 ions Ca2+ (2 charges +) et 2 ions Cl- ( 2 fois 1 charge -).
Au total l’édifice est électriquement neutre (+2 + 2x(+1) = 0).
3. La concentration massique d’une solution.
Lors d’une dissolution :
- La masse totale (solvant + soluté) se conserve)
- Le volume total, ne se conserve pas.
En général, le volume de la solution est plus grand que le volume du solvant seul. La concentration massique est définie par :
\[C_m = \frac{m}{V} \] Cm concentration massique (en g/L) m : masse de soluté dissous (en g) V : volume de la solution (en L)
Exemple : on dissout 2,0 mg de diiode dans de l’eau, pour former une solution de volume 5,0 mL
(la concentration massique de la solution sera : 4,0 g/L)
Remarque : ne pas confondre Cm et ρ masse volumique. L’expression est la même, mais pas la signification.
La fabrication des médicaments
https://physiquechimie.info/la-fabrication-des-medicaments-theme-sante-2/