Évolution des systèmes chimiques
Partie I : Les réactions d’oxydoréduction
1. Qu’est-ce qu’une réaction d’oxydoréduction ?
Lors d’une réaction d’oxydoréduction, il y a échange d’électrons entre un réducteur qui cède des électrons et un oxydant qui gagne des électrons.
- Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons.
Exemples : Zn2+, Cu2+, Cl2, … - Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
Exemples : Zn, Cu, Cl–, … - A tout oxydant correspond un réducteur formant un couple oxydant/réducteur.
Exemple : Cu2+(aq) / Cu(s) - Les couples redox peuvent également s’écrire sous la forme de demi-équations d’oxydoréduction ou demi-équations électroniques.
Exemple : Cu2+(aq) + 2e– = Cu(s)
2. Application :
- Ecrire les demi-équations d’oxydoréduction à partir des couples oxydant/réducteur ci-dessous.
Fe2+(aq) / Fe(s)
Fe3+(aq) / Fe2+(aq)
I2(aq) / I–(aq)
MnO4–(aq) / Mn2+(aq)
S4O62–(aq) / S2O32–(aq)
CO2 / H2C2O4
Réponses :
\[Fe^{2+} + 2 e^- = Fe\] \[Fe^{3+} + e^- = Fe^{2+}\] \[I_2 + 2 e^- = 2 I^{-}\] \[MnO_4^{-} + 8H^+ + 5 e^- = Mn^{2+} + 4 H_2O\] \[S_4O_6^{2-} + 2 e^- = 2 S_2O_3^{2-}\] \[2CO_2 + 2H^+ + 2 e^- = H_2C_2O_4\]
- On fait réagir en milieu acide une solution de permanganate de potassium (K+(aq) + MnO4–(aq)) avec une solution de sulfate de fer II (Fe2+(aq) + SO42–(aq)).
Les ions potassium K+ et les ions sulfate SO42–sont des ions spectateurs.
Réponse :
\[MnO_4^{-} + 8H^+ + 5 e^- = Mn^{2+} + 4 H_2O \] \[+ (Fe^{2+} = Fe^{3+} + e^-) \times 5 \] \[————————————\] \[MnO_4^{-} + 8H^+ + 5 Fe^{2+} \rightarrow Mn^{2+} + 5 Fe^{3+} + 4 H_2O\]
Partie II : Avancement d’une réaction
Exemple de transformation chimique.
On fait réagir 50 mL de sulfate de cuivre (Cu2+(aq) + SO42-(aq))) avec une solution d’hydroxyde de sodium (Na+(aq) + HO-(aq)).
Le tableau d’avancement de cette transformation est donné ci dessous.
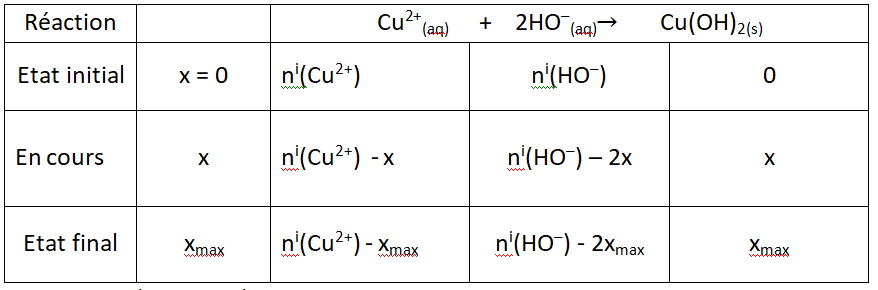
- La stœchiométrie de la réaction est 1 – 2 – 1
- x est l’avancement de la réaction (en moles) et xmax l’avancement maximal.
- Le réactif limitant est le réactif épuisé à l’état final. C’est le réactif qui arrête la réaction.
- Si à l’état final tous les réactifs sont épuisés, on dit que les réactifs ont été introduits dans les proportions stœchiométriques.
Détermination du réactif limitant
- Si Cu2+ est le réactif limitant :
\[x_{max} = \frac{n^i(Cu^{2+})}{1} \]
- Si OH- est le réactif limitant :
\[x_{max} = \frac{n^i(OH^{-})}{2} \]
\[Si \; \frac{n^i(Cu^{2+})}{1} < \frac{n^i(HO^{-})}{2} \; Cu^{2+} \; est \; le \; r\acute{e}actif \; limitant \; et \; x_{max} = \frac{n^i(Cu^{2+})}{1} \]
\[Si \; \frac{n^i(Cu^{2+})}{1} > \frac{n^i(HO^{-})}{2} \; HO^{-} \; est \; le \; r\acute{e}actif \; limitant \; et \;
x_{max} = \frac{n^i(HO^{-})}{2} \]
\[Si \; \frac{n^i(Cu^{2+})}{1} = \frac{n^i(HO^{-})}{2} \; les \; r\acute{e}actifs \; sont \; dans \; les \; proportions \; \\stoechiom\acute{e}triques \]
Évolution des systèmes chimiques