Composition des systèmes chimiques
Partie I : quantité de matière
1. Qu’est-ce que la quantité de matière n ?
- La quantité de matière se mesure en moles (mol)
- Une mole est un ensemble de 6,02.1023 entités élémentaires (atomes, ions molécules, …).
- Na = 6,02.1023 mol-1 s’appelle le nombre d’Avogadro. (Nombre d’atomes dans 12 g de carbone 12)
- La masse d’une mole, M, s’appelle la masse molaire et se mesure en g.mol-1.
- La masse molaire des atomes est donnée dans la classification périodique.
- La masse molaire des molécules est égale à la somme des masses molaires des atomes qui constituent la molécule.
Ex. : M(CO2) = M(C) + 2.M(O) - Idem pour les ions, sans tenir compte des électrons (charges)
- Le nombre d’entités élémentaires N est relié à la quantité de matière n, par : N = n.Na
2. Comment calculer une quantité de matière n ?
avec
m : masse en g
M : masse molaire en g.mol-1
n : quantité de matière en mol.
ou
avec
V : volume de la solution en L
C : concentration de la solution en mol.L-1
n quantité de matière de soluté dissous.
Par ailleurs :
La concentration massique vaut :
avec
m : masse de soluté en g
V : volume de la solution en L
Cm : concentration massique en g.L–1
Entre la concentration massique Cm et la concentration molaire C, on a la relation :
Soit
avec
n : quantité de matière en moles (mol)
V : volume du gaz en L (gaz uniquement)
Vm : volume molaire en L.mol-1 (Vm = 24,5 L.mol-1 à 25°C)
La loi d’Avogadro - Ampère :
Des volumes égaux de gaz différents,
pris dans les mêmes conditions de température
et de pression contiennent le même nombre de molécules,
donc le même nombre de moles.
On peut calculer la masse du volume V du liquide grâce à la masse volumique avec :
avec
ρ : masse volumique en g.mL-1 ou en g.cm-3)
V : volume de liquide en cm3 (ou mL)
m : masse en grammes (g)
On peut ensuite calculer la quantité de matière n avec la relation : n = m . M
En combinant les deux expressions, on obtient :
La masse volumique en g.cm-3 se calcule à partir de la densité par :
avec ρeau = 1,0 g.cm-3
La densité prend donc la même valeur que la masse volumique en cm3 (ou mL) mais sans les unités
Partie II : Spectrophotométrie
1. Couleurs et absorbance.
Couleur d’une solution : la couleur d’une solution est donnée par les radiations non absorbées par cette solution.
C’est la couleur complémentaire de la couleur absorbée, donnée par l’étoile chromatique (opposé sur l’étoile chromatique).Absorbance d’une solution : l’absorbance A est liée à l’intensité de la lumière absorbée pour une longueur d’onde.
Elle est mesurée par un spectrophotomètre.
La courbe de l’absorbance en fonction de la longueur d’onde λ, s’appelle un spectre d’absorption.
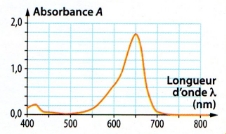
Le spectre d’absorption permet entre autre de trouver la longueur d’onde ou l’absorbance est maximale.
2. Dosage par étalonnage.
Loi de Beer-Lambert : Pour une longueur d’onde λ donnée, à une température et une épaisseur de solution traversée données, l’absorbance est proportionnelle à la concentration de l’espèce chimique responsable de sa couleur.
L’absorbance A est proportionnel à la concentration c soit :
Expression générale de la loi de Beer – Lambert est :
ελ : coefficient d’absorption ou d’extinction molaire
l : longueur de la cuve
C concentration de la solution
La loi de Beer-Lambert est valable uniquement pour les solutions diluées
Principe du dosage par étalonnage : la concentration d’une espèce chimique colorée est déterminée grâce à une courbe d’étalonnage réalisée à partir de la mesure de l’absorbance de solutions étalons d’une échelle de teintes.
Réglage du spectrophotomètre :
– Pour une meilleure précision, on se place à la longueur d’onde où l’absorbance A est maximale.
– Avant les mesures, on fait le « blanc ». Cette opération consiste à éliminer l’absorbance du solvant et de la cuve avec une cuve contenant du solvant seul.
Atotal = Asolvant + Acuve + Asoluté (additivité des absorbances)
On trace ensuite la courbe d’étalonnage, A = f(c).

On détermine la concentration de la solution inconue par deux méthodes :
- Par lecture graphique directe sur la courbe d’étalonnage.
- En utilisant l’équation numérique de la droite d’étalonnage (correspondant à la loi de Beer-Lambert A = k.C), puis en calculant C.
Composition des systèmes chimiques