Interaction lumière-matière, quantification de l'énergie de l'atome [images et couleurs]
La lumière se comporte parfois comme une onde, parfois comme une particule. Ce concept est à l’origine de la mécanique quantique.
Pourquoi dit-on que l’énergie de l’atome est quantifiée ? Quelle est l’énergie des particules de lumière, les photons ? Comment interagissent les photons avec la matière ?
Comment expliquer les spectres de raies d’émission ou d’absorption des atomes ?
Nous allons répondre à toutes ces questions ?
1. La lumière possède un caractère ondulatoire.
La lumière est une onde électromagnétique. Chaque radiation lumineuse est caractérisée par sa longueur d’onde dans le vide λ (lambda) ou sa fréquence ν (nu)
La longueur d’onde dans le vide et la fréquence de l’onde sont reliés par la relation :
$$ \lambda = \frac{c}{\nu} $$
c : célérité de la lumière dans le vide = 3,00.108 m.s-1.
ν : fréquence en hertz (Hz)
λ : longueur d’onde dans le vide en mètres (m)
2. La lumière possède également un caractère corpusculaire (particule)
Les échanges d’énergie entre la matière et la lumière et la matière sont quantifiés.
Les atomes ou les molécules ne peuvent échanger que certaines valeurs d’énergie, appelées quanta d’énergie (quantum au singulier).
Un quantum d’énergie est transporté par une particule appelée photon.
L’énergie E transportée par un photon est reliée à la fréquence de l’onde par la relation :
\[ E = h.\nu \]
E : énergie du photon en joules (J)
ν : fréquence de l’onde en hertz (Hz)
h = 6,63.10-34 J.s est la constante de Planck
L’énergie est souvent exprimée en électrons-volts (eV) : 1 eV = 1,6 . 10-19 joules (J)
3. Les niveaux d’énergie des atomes sont quantifiés.
Les échanges d’énergie avec les atomes étant quantifiés, les niveaux d’énergie le sont aussi.
Les niveaux d’énergie forment ainsi une suite discrète.

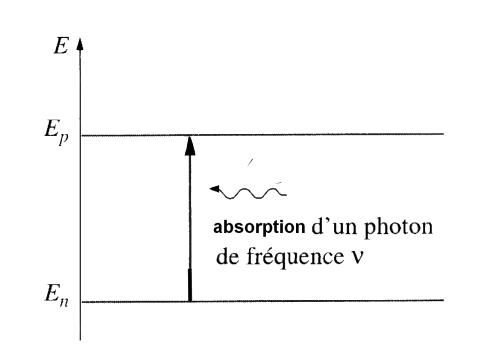
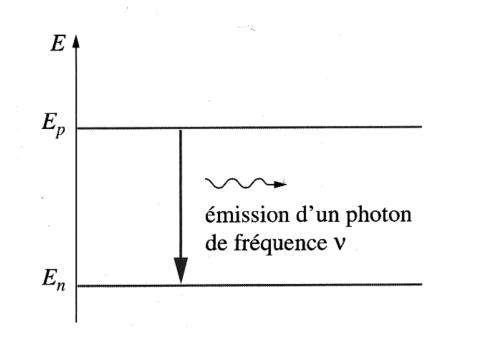
Le passage d’un niveau d’énergie à un autre s’appelle une transition et s’accompagne de l’émission ou de l’absorption d’un photon.
L’énergie échangée lors d’une transition est égale à la différence entre les énergies des deux niveaux d’une transition.
D’où la relation : \[ ΔE = E_{p} - E_{n} = h.\nu = \frac{h.c}{\lambda}\quad \quad \]
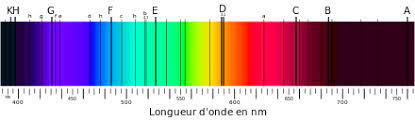
Les spectres de raies d’émission et d’absorption sont l’expression de la quantification de l’énergie de l’atome.
Les raies d’émission ou d’absorption d’un élément chimique sont caractéristiques de cet élément.
4. Le spectre solaire.
Le Soleil émet un rayonnement continu d’origine thermique présentant des raies sombres d’absorption.
Interaction lumière-matière, quantification de l'énergie de l'atome [images et couleurs]
![Interaction lumière-matière, quantification de l'énergie de l'atome [images et couleurs]](/assets/atomes-photons.jpg)