La composition des médicaments : méthodes d'extraction et de caractérisation [Thème santé]
Dans cette partie on s’intéresse à la composition des médicaments et ou méthodes permettant de séparer et d’identifier une espèce chimique dans un médicament.
1. La notice des médicaments.
Un médicament est composé :
- D’un ou plusieurs principes actifs : substances chimiques ayant un intérêt thérapeutique.
- D’excipients : substances qui facilitent l’administration, la conservation et l’absorption du principe actif
2. Comment caractériser une espèce chimique ?
2-1 Par sa température de changement d’état.
Les différents changements d’état
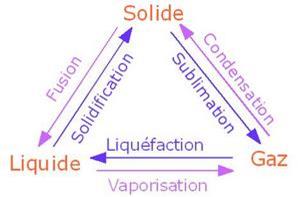
Le changement d’état d’un corps pur se fait à température constante
- solide-liquide –> température de fusion
- liquide-vapeur –> température d’ébullition
Application : Pour déterminer la température de fusion d’un solide on peut utiliser un banc Kofler.
Dans le cas de la détermination de la température d’ébullition d’un liquide on utilisera un tube de Thiele.
2.2 Par la solubilité
La solubilité d’une espèce chimique est la masse maximale de soluté que l’on peut dissoudre dans un litre d’eau (à une température donnée). La solubilité s’exprime en g.L-1.
Lorsque la solubilité est atteinte, la solution est saturée, on ne peut plus dissoudre de soluté.
Exemple : solubilité du sel dans l’eau 360 g.L-1
On peut dissoudre au maximum 360 g de el dans un litre d’eau. Au-delà, le sel ne se dissout plus.
2.3 La masse volumique et la densité
La masse volumique μ ou ρ d’un corps est la masse d’une unité de volume de ce corps.
$$\rho = \frac{m}{V} $$
m : masse du corps en kg ou kg ou g
V : volume du corps en m3 ou L cm3 (mL)
ρ : masse volumique en kg.m-3 ou kg/L ou g.cm-3
Conversions : 1L = 1 dm3 1 mL = 1 cm3
Masse volumique de l’eau : 1,0 kg /L ou 1,0 g/cm3 (ou g/mL)
La densité d, d’un corps, est le rapport de la masse de ce corps sur la masse du même volume d’eau ou encore le rapport de la masse volumique du corps sur la masse volumique de l’eau : $$ d = \frac{\rho_{corps}}{\rho_{eau}} $$ Si la masse volumique est exprimée en g/cm3, alors elle prend la même valeur que la densité car la masse volumique de l’eau en g/cm3 vaut 1,0 g/cm3.
Soit : $$ d = \frac{\rho_{corps}}{1,0} $$ Dans ce cas, la masse volumique doit être en g/cm3
Exemples de densités de liquide :
deau = 1,0
ddicloro = 1,33
déthanol = 0,8
dcyclohexane = 0,78
Remarque :
- Si d > 1 le corps coule dans l’eau (plus dense que l’eau)
- Si d < 1 le corps flotte dans l’eau (moins dense que l’eu)
2.4 La chromatographie
Schéma d’une chromatographie sur couche mince :
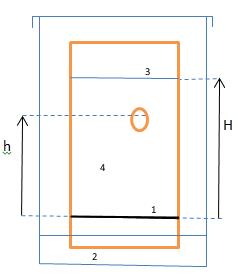
1 - Ligne de dépôt
2 - Phase mobile : éluant
3- Front de l’éluant
4- phase fixe : plaque c.c.m.
Principe de la chromatographie :
Lors de l’élution, l’éluant migre sur le support fixe et entraîne avec lui les différents constituants du mélange.
Plus une espèce chimique est soluble dans l’éluant, plus elle sera entraînée facilement donc plus elle migrera loin de la ligne de dépôt.
- Le nombre de taches verticales correspond au nombre de constituants du mélange étudié.
- Deux taches à la même hauteur correspondent à la même espèce chimique.
La chromatographie est une méthode de séparation et d’identification des espèces chimiques d’un mélange.
Le rapport frontal Rf vaut : $$ R_f = \frac{h}{H} $$
Pour un solvant donné, le rapport frontal est caractéristique d’une espèce chimique.
La hauteur d’une tache se mesure par rapport au milieu de la tache
3. Comment extraire une espèce chimique ?
3.1 Extraction par solvant
Une espèce chimique est extraite d’une phase (solvant) par **un autre solvant dans lequel cette espèce est très soluble.
Les deux solvants doivent être non miscibles l’un avec l’autre.
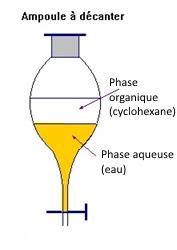
On utilise une ampoule à décanter pour séparer les deux phases.
3.2 Extraction par distillation ou hydrodistillation.
- L’hydrodistillation permet d’extraire des espèces chimiques grâce à la vapeur d’eau. La vapeur d’eau entraine avec elle les espèces à extraire (par exemple les huiles essentielles).
Les vapeurs sont ensuite condensées dans le réfrigérant, pour donner le distillat.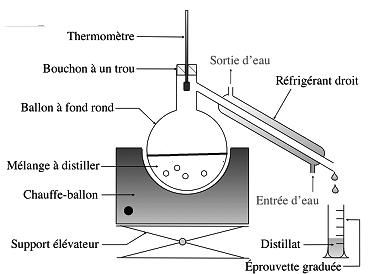
- La distillation fractionnée permet de séparer deux liquides dont les températures d’ébullition sont différentes.
Par exemple : l’eau et l’éthanol (alcool) Le mélange est chauffé jusqu’à ébullition.
Le composé le plus volatil se retrouve majoritairement dans la vapeur.
Cette vapeur condensée dans le réfrigérant donne le distillat.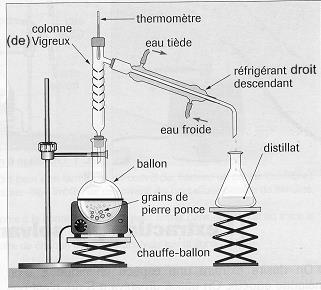
3.3 La filtration
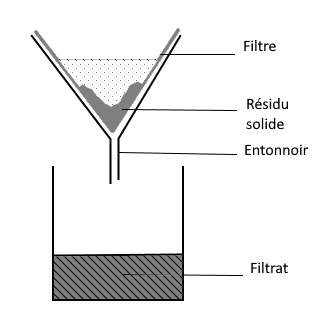
La filtration permet de séparer un solide d’un liquide grâce à un filtre. Le liquide recueilli s’appelle le filtrat.
La composition des médicaments : méthodes d'extraction et de caractérisation [Thème santé]
![La composition des médicaments : méthodes d'extraction et de caractérisation [Thème santé]](/uploads/2014/12/medicament.jpg)