Réaction chimique et dosage. [images et couleur]
Comment modélise-ton une transformation chimique ? Comment suit-on une transformation chimique ? Qu’est-que l’avancement d’une transformation ?
Qu’est-ce qu’un titrage ? A quoi sert-il et comment l’exploite-t-on ?
Voici les questions auxquelles nous allons répondre
1. La réaction chimique
Une transformation chimique se produit lorsqu’une réaction chimique fait évoluer un système chimique d’un état initial vers un état final.
Cette transformation peut-être modélisée par une équation, c’est l’équation de la réaction.
La Stœchiométrie correspond aux relations de proportionnalité qui existent entre les quantités de matière formées des produits et les quantités de matière des réactifs consommées lors d’une transformation chimique.
Considérons l’équation de la réaction suivante :
CH4(aq) + 2 O2(g) → CO2(g) + 2 H2O(l)
La stœchiométrie de la réaction ci-dessus est : 1 – 2 – 1 - 2
Il y a 2 fois plus de dioxygène qui réagit que de méthane.
Il se forme 2 fois plus d’eau que de dioxyde de carbone.
Il y a autant de CH4 disparu que de CO2 formé.
Il y a autant de O2 disparu que de H2O formé.
L’évolution d’un système chimique est caractérisée par l’avancement x de la réaction.
L’avancement x de la réaction, s’exprime en mol.
Au cours d’une transformation chimique, l’avancement de la réaction x augmente jusqu’à l’état final ou l’un des réactifs, le réactif limitant, est épuisé.
L’avancement atteint alors sa valeur maximale notée xmax. Si à la fin de la transformation chimique tous les réactifs sont épuisés, ceux-ci ont été introduits dans les proportions stœchiométriques, c-à-d dans les proportions de la réaction.
Un tableau d’avancement ou d’évolution, permet de suivre l’évolution des quantités de matière de chaque espèce au cours d’une transformation chimique.
2. Dosage par étalonnage.
Couleur d’une solution : la couleur d’une solution correspond aux radiations non absorbée par cette solution. Elle est complémentaire de la couleur absorbée.
Absorbance d’une solution : l’absorbance A est liée à l’intensité de la lumière absorbée pour une longueur d’onde. Elle est mesurée par un spectrophotomètre. L’absorbance A est une fonction de la longueur d’onde λ
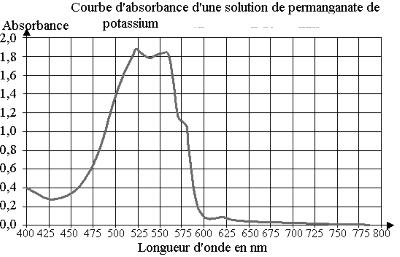
Spectre d’absorption : pour une solution colorée, la courbe A = f(λ) s’appelle le spectre d’absorption de la solution.
Loi de Beer-Lambert : Pour une longueur d’onde λ donnée, à une température et une épaisseur de solution traversée données, l’absorbance est proportionnelle à la concentration C de l’espèce chimique responsable de sa couleur.
C’est la loi de Beer – Lambert :
A= k.C
Plus généralement A = ε.λ.l.C
- Dosage par étalonnage : la concentration d’une espèce chimique colorée est déterminée grâce à une courbe d’étalonnage réalisée à partir de la mesure de l’absorbance de solutions étalons. On commence donc par réaliser une échelle de teintes, un ensemble de solutions de concentrations données dont on déterminera l’absorbance.
- Réglages préliminaires du spectrophotomètre : pour une meilleure précision, on se place à la longueur d’onde où l’absorbance est maximale λmax. L’absorbance maximale d’une solution s’obtient en traçant le spectre d’absorption du composé.
 Avant chaque mesure, on réalise le « blanc ». Cette opération consiste à éliminer l’absorbance du solvant et de la cuve, en plaçant une cuve contenant du solvant seul (souvent de l’eau distillée) dans le spectrophotomètre.
Avant chaque mesure, on réalise le « blanc ». Cette opération consiste à éliminer l’absorbance du solvant et de la cuve, en plaçant une cuve contenant du solvant seul (souvent de l’eau distillée) dans le spectrophotomètre. - On trace ensuite la courbe de l’absorbance en fonction de la concentration, A = f(c).
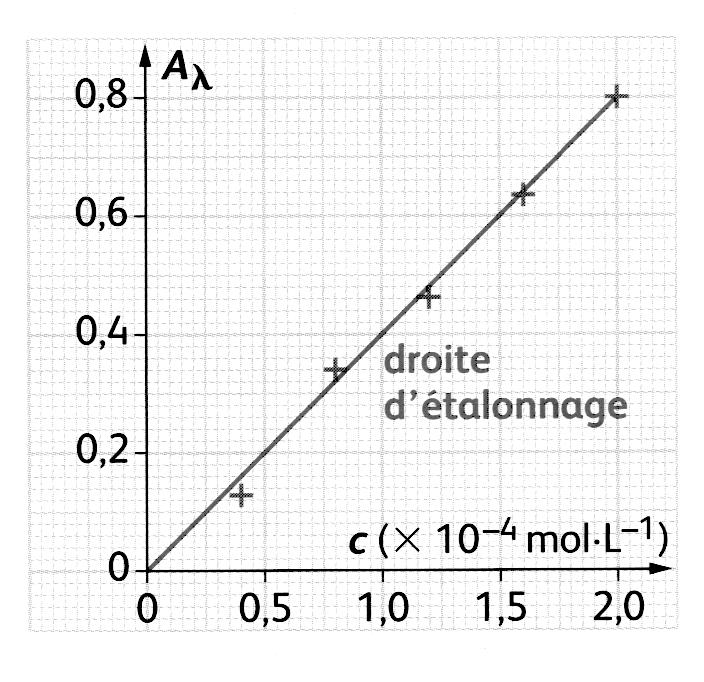
- Détermination de la concentration : Après avoir mesuré l’absorbance de la solution inconnue, on détermine par lecture graphique sur la courbe d’étalonnage la concentration de l’espèce chimique colorée à doser.
Réaction chimique et dosage. [images et couleur]
https://physiquechimie.info/reaction-chimique-et-dosage-images-et-couleur/
![Réaction chimique et dosage. [images et couleur]](/uploads/2015/02/reaction-chimique.jpg)