La géométrie des molécules [images et couleur]
Peut-on prévoir la géométrie d’une molécule à partir de sa représentation de Lewis ?
C’est a question à laquelle nous allons répondre.
1- Représentation de Lewis d’une molécule
- Dans la représentation de Lewis d’une molécule, tous les électrons de valence (de le couche externe) des atomes sont représentés par des tirets symbolisant les doublets d’électrons liants ou non-liants. Les atomes satisfont la règle du duet et de l’octet avec 4 doublets d’électrons (2 pour la règle du duet).
Les doublets liants correspondent à la mise en commun de deux électrons de deux atomes pour former une liaison covalente.
Les doublets non liants sont des doublets d’électrons n’intervenant pas dans une liaison covalente entre deux atomes.
- Pour établir la représentation de Lewis d’une molécule :
→ Ecrire les structures électroniques des atomes qui constituent la molécule, dénombrer les électrons de valence (périphériques) et déterminer le nombre de liaison que chacun des atomes doit établir afin de satisfaire la règle du duet et de l’octet.
→ Déterminer le nombre de doublets non-liants que chacun des atomes doit établir afin d’être entouré de quatre doublets d’électrons pour respecter la règle de l’octet.
→ Représenter alors la molécule en respectant le nombre de liaisons et de doublets non-liants déterminés.
→ Vérifier que chacun des atomes (sauf H) soit bien entouré de 8 électrons soit quatre doublets (quatre tirets)
Exemple : CO2
Le carbone C : K2L4 peut réaliser 4 liaisons (pour avoir 8 sur la dernière couche)
L’oxygène O : K2L6 peut réaliser 2 liaisons covalentes et possède 2 doublets non-liants (pour avoir 8 sur la dernière couche)
Dans la moléducle de CO2, a donc comme représentation de Lewis
2- Géométrie d’une molécule
Les doublets d’un atome se répartissent dans l’espace de façon à minimiser la répulsion électrique des électrons négatifs de même signe, entre eux.
Ainsi quatre doublets électroniques se répartirons dans l’espace selon un tétraèdre.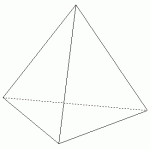
Pour prévoir la géométrie d’une molécule, il faut connaître les doublets liants et non-liants de l’atome central :
| Nombre de doublets liants et non-liants : | Géométrie |
|---|---|
| 2 doubles liaisons | Linéaire |
| 2 liaisons simples et 1 double liaison | plane |
| 4 liaisons simples | tétraédrique |
| 3 liaisons simples et 1 doublet non-liant | pyramidale |
| 2 liaisons simples et 2 doublets non-liants | coudée |
Exemples : CH4 (tétraédrique) - NH3 (pyramidale) - H2O (coudée)
3- Isomérie Z/E
Deux molécules isomères Z/E ont même formule brute, même formule semi-développée mais des formules développées différentes.
Pour qu’une isomérie Z/E existe, il est nécessaire :
- Que la molécule possède une double liaison
- Que chaque atome engagé dans cette double liaison soit lié à deux groupes d’atomes différents.
Isomère E Isomère Z

Une isomérisation photochimique de la molécule de rétinal est à l’origine du processus de la vision
La géométrie des molécules [images et couleur]
https://physiquechimie.info/la-geometrie-des-molecules-images-et-couleur/
![La géométrie des molécules [images et couleur]](/assets/geometrie_molecules.jpg)